Konopie większości ludzi kojarzą się z latami 70. XX wieku, nadużywaniem narkotyków oraz uzależnieniem. I nie do końca słusznie. Dlaczego? Powszechnie uważa się, że istnieje tylko jeden rodzaj konopi – konopie indyjskie (Cannabis sativa L. var. indica), z których otrzymuje się marihuanę lub haszysz. Jednak konopie to także odmiana siewna (Cannabis sativa L. var. sativa).
Każdy z tych gatunków charakteryzuje się inną zawartością substancji aktywnych, do których zaliczamy np. kannabinoidy. Konopie indyjskie dużą popularność zdobyły przede wszystkim z racji wykorzystania ich właściwości halucynogennych oraz leczniczych. Wg badań naukowych szkodliwość marihuany jest znikoma, w porównaniu np. do picia legalnego alkoholu czy nawet palenia tytoniu. Nie, to nie znaczy, że marihuana jest całkiem obojętna dla ustroju, niemniej z niewyjaśnionych przyczyn jest w Polsce piętnowana. Na świecie po kannabinoidy (np. marihuanę, haszysz, syntetyczne imitacje) sięga ok. 182.5 miliona ludzi (3.8% populacji). Używanie marihuany („rekreacyjne”) jest legalne w 10 stanach, a „medyczna marihuana” jest legalna w 33 stanach USA. Co najmniej 18 milionów Amerykanów obecnie używa marihuany. W Izraelu co najmniej 30 tysięcy pacjentów sięga po „medyczną marihuanę” (zawiera dużo CBD, a stosunkowo mało THC).
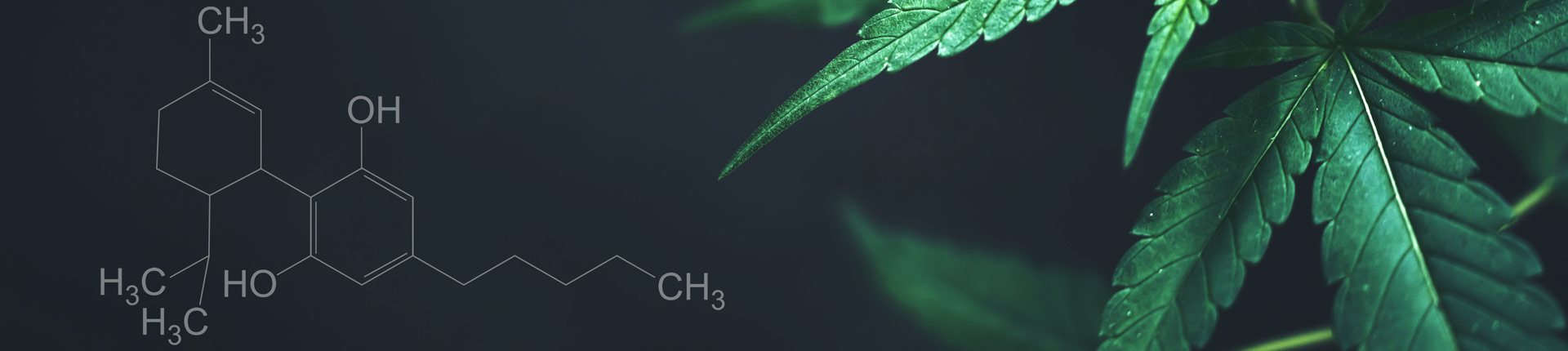
Przez wieki wiele preparatów leczniczych pochodzących z cannabis sativa (konopi siewnych) stosowano w przypadku różnych zaburzeń, w tym dny moczanowej, reumatyzmu, malarii, leczenia bólu i gorączki. Niektóre źródła podają, iż konopie były stosowane nawet 5000 lat temu, jednak zachodnia medycyna rozpoznała ich potencjał dopiero w XIX wieku. Szczegółowe mechanizmy działania, budowa chemiczna i punkty uchwytu konopi zostały odkryte niedawno. Ustalono, iż konopie zawierają przynajmniej 420 różnych związków, w tym 66 zwanych kannabinoidami. Najbardziej znanym z nich jest THC [delta-9-tetrahydrokannabinol; (−)-trans-Δ9-tetrahydrocannabinol (Δ9-THC)]. Ma on właściwości narkotyczne.
Jednak w roślinach znajdują się także m.in.:
- Δ8-THC,
- Kannabidiol (CBD),
- Kannabinol (CBN) - powstaje wskutek utleniania THC wskutek oddziaływania np. kwasu,
- Δ9-tetrahydrocannabivarin (Δ9-THCV).
Kannabinol (CBN) najprawdopodobniej powstaje z THC podczas przechowywania zebranej konopi. Był pierwszym wyizolowanym pod koniec XIX wieku roślinnym fitokannabinoidem. Jego struktura została poznana we wczesnych latach 30. XX wieku przez R.S. Cahna, a synteza chemiczna powiodła się dopiero w 1940 r. w laboratoriach R. Adamsa (USA) oraz Lord Todd w Wielkiej Brytanii.
Drugi fitokannabinoid, Kannabidiol (CBD), pozyskano z konopi w 1940 r. przez Adamsa i wsp. Najprawdopodobniej CBD towarzyszył kwas kannabidiolowy (CBDA).
THC (Δ9-THC) pozyskano pierwszy raz w 1942 r. dzięki pracy Wollnera, Matchetta, Levine’a i Loewe. Najprawdopodobniej był mieszaniną (−)-Δ8- oraz (−)-Δ9-THC. Zarówno THC, jak i CBD, występują w konopi, jako kwasy (odpowiednio: kwas tetrahydrokannabinolowy oraz kwas kannabidiolowy), które są dekarboksylowane, gdy konopia jest podgrzewana.
Jak działają kannabinoidy?
W organizmach ssaków wykryto dwa rodzaje receptorów kannabinoidowych: CB1 i CB2. Receptory CB1 składają się z 472, a receptory CB2 z 360 aminokwasów. Klasyfikuje się, jako receptory sprzężone z białkiem G. Receptory CB1 są zlokalizowane na zakończeniach nerwowych w ośrodkowym (mózg i rdzeń kręgowy) i obwodowym układzie nerwowym. Oprócz swoich głównych receptorów w mózgu (np. w rejonie podwzgórza i przodomózgowia), niektóre receptory CB1 znajdują się w innych obszarach ciała, w tym w żołądku i jelitach.
Ich rola? Wspólnie z receptorami waniloidowymi (TRPV1) modyfikują uwalnianie neurotransmiterów do szczeliny synaptycznej. Z receptorami kannabinoidowymi mogą łączyć się tetrahydrokannabinol i jego analogi, a także endogenne kannabinoidy, takie jak anandamid, 2-arachidonyloglicerol, eter noladyny, a także endovanilloid (zwany też N-arachidonoyletanolaminą, dopaminą N-arachidonylową, NADA). Ligandami są także palmitoiloetanolamid (PEA) czy oleiloetanolamid (OEA). Jedynym zbadanym endogennym ligandem, który wykazuje cechy antagonistyczne wobec receptorów endokannabinoidowych jest wirodhamina.
Receptory CB2 znajdują się głównie w mózgu i układzie odpornościowym, a także neuronach obwodowych, w tym w dolnych drogach moczowych. Znaleziono je także w kardiomiocytach, kardiomioblastach, a także w komórkach śródbłonka tętnic wieńcowych i komórkach mięśni gładkich naczyń krwionośnych. Substancje pobudzające receptory stymulują łaknienie, więc zaczęto eksperymentować z ich antagonistami (rimonabant).
Czym się różnią THC i CBD?
THC (Tetrahydrokanabinol) jest częściowym agonistą zarówno receptorów CB1, jak i receptorów CB2. W większym stopniu wpływa na receptory CB1, dlatego ma działanie psychoaktywne.
Kannabidiol (CBD) cechuje się mniejszym powinowactwem do obu receptorów i wywiera działanie, jako antagonista w stosunku do receptorów CB1 i jako odwrotny agonista w stosunku do CB2. Obwodowo CBD wykazuje się o wiele większą mocą, niż wynika to z jego powinowactwa do receptorów CB1/CB2. Najprawdopodobniej wykazuje również modulację endokannabinoidową. Wykazuje działanie przeciwlękowe, przeciwzapalne, przeciwwymiotne i przeciwpsychotyczne. Najprawdopodobniej wykazuje również właściwości ochronne dla układu nerwowego. CBD jest bardziej skuteczny, niż witamina C i E, jako przeciwutleniacz (neuroprotekcyjny) i może polepszyć stan skóry np. przy trądziku. Kannabidiol może działać synergistycznie razem z THC, antagonizując działanie psychoaktywne i sedacyjne, nasilając zaś efekty kliniczne kanabinoidów (czyli zmniejsza oddziaływanie narkotyczne marihuany, zaś wspomaga jej właściwości lecznicze).
Uważa się, iż receptory CB1 mają duże znaczenie w powstawaniu otyłości, gdyż regulują homeostazę (podaż energii w postaci pokarmu). Opisano liczne związki między nosicielstwem polimorfizmów pojedynczych nukleotydów (SNP) genu CNR1 a zwiększonym spożyciem pokarmów, obwodem talii, wskaźnikiem masy ciała (BMI) i występowaniem zespołu metabolicznego. Wydaje się, że bezpośrednia aktywacja receptorów CB1 sprzyja wzmożonej lipogenezie, stłuszczeniu osierdzia i zaburzeniom czynności bioelektrycznej serca. A więc Kannabidiol (CBD), jako antagonista receptorów CB1, mógłby wykazywać właściwości sprzyjające odchudzaniu! I faktycznie, obserwacje Parray HA i wsp. opublikowane w maju 2016 r. wskazują, iż CBD wywiera wpływ na adipocyty (ich brązowienie), zwiększenie lipolizy, termogenezę i zmniejszenie lipogenezy. Na razie trzeba poczekać na większą liczbę badań, w tym klinicznych. Niemniej to obiecujący kierunek.
Czy stosowanie preparatów z konopi jest legalne?
Zgodnie z polskimi regulacjami prawnymi legalne są konopie włókniste, rośliny z gatunku konopie siewne (Cannabis sativa L.), w których suma zawartości delta-9-tetrahydrokannabinolu oraz kwasu tetrahydrokannabinolowego (kwasu delta-9-THC-2-karboksylowego) w kwiatowych lub owocujących wierzchołkach roślin, z których nie usunięto żywicy, nie przekracza 0,20% w przeliczeniu na suchą masę. Dla porównania, konopie stosowane w celach narkotycznych zawierają THC w ilości około 1,5-3% kwiatostanu, natomiast liście wiechy zawierają ok. 1%, a żywica ok. 5% D-9-tetrahydrokannabinolu.
Medyczne zastosowanie dla konopi
FDA dopuściło do obrotu w 1985 r. dronabinol. Inne podmioty regulacyjne nie pozostały w tyle rejestrując np. nabilone (Cesamet) czy też nabiximol (Sativex), jako leki przeciwwymiotne, przeciwbólowe lub przeciwspastyczne.
Konopie znalazły dość szerokie zastosowanie w medycynie:
- sativex (nabiximols) stosuje się w leczeniu objawowym pacjentów ze stwardnieniem rozsianym. Został zatwierdzony w Kanadzie w 2005 r. do leczenia ośrodkowego bólu neuropatycznego w stwardnieniu rozsianym, a w 2007 r. w terapii bólu związanego z rakiem. Zawiera Δ9-THC oraz CBD,
- dronabinol (δ-9-tetrahydrokannabinol) stosuje się w leczeniu utraty apetytu, który powoduje utratę masy ciała u osób z AIDS. Dronabinol jest również stosowany w leczeniu nudności i wymiotów spowodowanych chemioterapią,
- konopie stosuje się przy przewlekłym ból neuropatycznym, chorobie nowotworowej oraz zespole Touretta – chorobie nerwowych tików,
- olej zawierający CBD ma działanie przeciwlękowe, przeciwzapalne, przeciwwymiotne i przeciwpsychotyczne. Być może znajdzie zastosowanie w wspomaganiu leczenia schizofrenii i otępienia, a także cukrzycy. Obiecującym kierunkiem jest wykorzystanie CBD, jako środka odchudzającego.
Leczenie psychozy i zaburzeń dwubiegunowych
W 4-tygodniowym badaniu działanie CBD sprawdzano na pacjentach z chorobą Parkinsona z objawami psychotycznymi. Podano doustne dawki CBD w dawce 150-400 mg dziennie. Stosowanie CBD zmniejszyło nasilenie objawów psychotycznych. Ponadto nie zgłoszono żadnych poważnych skutków ubocznych, ani upośledzenia zdolności poznawczych i funkcji motorycznych.
W komunikacie prasowym „GW Pharmaceuticals” z 15 września 2015 r. opisano 88 pacjentów z oporną na leczenie schizofrenią. Podawano im oprócz leków, także CBD lub placebo. Ważne parametry kliniczne uległy poprawie w grupie CBD, odnotowano niewiele skutków ubocznych, ich częstotliwość była podobna do do grupy placebo.
Dronabinol (δ-9-tetrahydrokannabinol) stosuje się w leczeniu utraty apetytu, który powoduje utratę masy ciała u osób z AIDS. Dronabinol jest również stosowany w leczeniu nudności i wymiotów spowodowanych chemioterapią. Wtedy podaje się go na czczo, 30 minut przed jedzeniem oraz 1-3 h przed chemioterapią. Dronabinol zwykle stosuje się, jako lek kolejnego rzutu, gdy klasyczne środki okażą się nieskuteczne. Środka nie powinni stosować kierowcy, bo może powodować zawroty głowy lub senność. Ponadto wchodzi w interakcję z wieloma lekami, więc należy dobrze rozważyć jego stosowanie. Środek może być nadużywany przez narkomanów, gdyż jest w stanie wywoływać euforię, uczucie „szczęścia”, nietypowe myśli, zaburzenia funkcjonowania itd.
Na rynku istniały środki działające antagonistycznie do marihuany np. taranabant oraz rimonabant (SR141716A), selektywny antagonista receptora kanabinoidowego CB1. Rimonabant został wycofany 23 października 2008. Zwiększał liczbę samobójstw. Występował pod nazwą handlową Acomplia i do dzisiaj w obrocie istnieją jego nielegalne podróbki. Powstało też wiele substancji syntetycznych, takich jak (−)-11-hydroxy-Δ8-THC-dimethylheptyl (HU-210), JWH-018, JWH-073.
Czy to jest bezpieczne?
Przegląd 132 badań przeprowadzony przez Bergamaschi i wsp. wskazuje, iż kannabidiol (CBD) jest bezpieczny, nie wywołuje katalepsji, przy jego stosowaniu nie stwierdzono zmian tętna, ciśnienia krwi czy temperatury ciała. Co więcej, kannabidiol nie wpływa negatywnie na funkcjonowanie psychomotoryczne i funkcje poznawcze. Nie wywiera wpływu na układ pokarmowy, podaż pokarmu i nie stwierdzono toksycznego oddziaływania na komórki. Dawki do 1500 mg dziennie wielokrotnie były uznawane za bezpieczne i dobrze tolerowane przez ludzi. Jak każdy preparat, CBD może mieć pewne skutki uboczne, ale głównie wykazywano je w badaniach na zwierzętach i in vitro (poza ustrojem człowieka). Być może CBD wykazuje wpływ na metabolizm niektórych leków (tak samo jest z wieloma rodzajami ziół np. dziurawcem, a nawet z sokiem grejpfrutowym, karambolą, żurawiną, cytryną, sokiem z pomelo czy z granatu).
Z pewnością groźne dla zdrowia są syntetyczne kannabinoidy (powiązano je np. z uszkodzeniami nerek). Ponadto są zakazane przez WADA, zostały sklasyfikowane w kategorii S8: obok tradycyjnej konopii oraz haszyszu, klasyfikuje się tu również mimetyki, takie jak: JWH-018, JWH-073, HU-210.
Jednak nie należy mylić CBD z marihuaną lub syntetycznymi kannabinoidami, bo to zupełnie inna klasa związków. CBD wykazuje wiele ciekawych właściwości w tym działanie przeciwzapalne, ważne chociażby w kontekście zwyrodnieniowej choroby stawów. Ponadto CBD jest antyoksydantem, znajduje zastosowanie, jako środek przeciwlękowy, przeciwwymiotny i przeciwpsychotyczny. Być może będzie stosowany przy odchudzaniu, co z pewnością zainteresuje kulturystów, zawodniczki fitness, a także zwykłych bywalców klubów.
Referencje:
Roger G Pertwee “Cannabinoid pharmacology: the first 66 years” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1760722/
MECHOULAM R. 1986The pharmacohistory of Cannabis sativa Cannabinoids as Therapeutic Agentsed. Mechoulam, R. pp. 1–19.Boca Raton, FL: CRC Press
Agnieszka Polak, Ewa Harasim, Adrian Chabowski „Wpływ aktywacji układu endokannabinoidowego na metabolizm mięśnia sercowego” https://pdfs.semanticscholar.org/0c89/f0505a105bf88c1afc13880cdf741c7be10b.pdf
Torsten Lowincorresponding author and Rainer H. Straub “Cannabinoid-based drugs targeting CB1 and TRPV1, the sympathetic nervous system, and arthritis” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4561168/
Parray HA1, Yun JW2 “Cannabidiol promotes browning in 3T3-L1 adipocytes.” https://www.ncbi.nlm.nih.gov/pubmed/27067870
Kerstin Iffland and Franjo Grotenhermen „An Update on Safety and Side Effects of Cannabidiol: A Review of Clinical Data and Relevant Animal Studies” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5569602/
dr n. med. Agnieszka Piechal,1,2 dr n. med. Kamilla Blecharz-Klin1 „Leki przeciwwymiotne” https://podyplomie.pl/medycyna/16197,leki-przeciwwymiotne
Maurycy Pawlak, Łukasz Łaczmański, Andrzej Milewicz „Rola układu endokannabinoidowego i polimorfizmów genu CNR1 w powstawaniu otyłości” Katedra i Klinika Endokrynologii, Diabetologii i Leczenia Izotopami Akademii Medycznej im. Piastów Śląskich we Wrocławiu
Halina Bartosik-Psujek1, Małgorzata Malec-Milewska2, Tomasz Berkowicz3,Bartosz Jędrzejewski4, Piotr Radziszewski5, Krzysztof Selma „Nowoczesne leczenie objawowe w stwardnieniu rozsianym” https://journals.viamedica.pl/polski_przeglad_neurologiczny/article/download/36912/26420
Manuel Guzmán „Cannabis for the Management of Cancer Symptoms: THC Version 2.0?” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5961457/
„U S T A W A z dnia 29 lipca 2005r. o przeciwdziałaniu narkomanii” http://prawo.sejm.gov.pl/isap.nsf/download.xsp/WDU20051791485/U/D20051485Lj.pdf
https://www.drugs.com/mtm/dronabinol.html
Yi Yang,1,,2 Melissa M. Lewis,1,,3 Angelica M. Bello,1,,2 Ewa Wasilewski,1,,3 Hance A. Clarke,4,,5 and Lakshmi P. Kotra „Cannabis sativa (Hemp) Seeds, Δ9-Tetrahydrocannabinol, and Potential Overdose” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5665515/
http://www.czytelniamedyczna.pl/5989,konopie-siewne-cannabis-sativa-l-wartosciowa-roslina-uzytkowa-i-lecznicza.html
asp. dr Maciej Rymanowski „Konopie, przegląd zagadnień związanych z oznaczaniem sumarycznej zawartości delta-9-tetrahydrokannabinolu (D-9-THC) oraz kwasu delta-9-tetrahydrokannabinolowego (D-9-THCA-A)” http://cejsh.icm.edu.pl/cejsh/element/bwmeta1.element.desklight-64cd4bac-d918-4288-ba98-89fdbea133c0/c/rymanowski.pdf
Yu-Hui Jenny Huang,1 Zuo-Feng Zhang,2 Donald P. Tashkin,3 Bingjian Feng,4 Kurt Straif,5 and Mia Hashibe1 „An epidemiologic review of marijuana and cancer: an update” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4302404/
Bar-Lev Schleider L, Mechoulam R, Lederman V, et al. Prospective analysis of safety and efficacy of medical cannabis in large unselected population of patients with cancer. Eur J Intern Med. 2018;49:37–43
William F. Pendergraft, III,*†‡ Leal C. Herlitz,§ Denyse Thornley-Brown, Mitchell Rosner,¶ and John L. Nilescorresponding author†‡ “Nephrotoxic Effects of Common and Emerging Drugs of Abuse” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4220747/










Cześć, super artykuł!